
Alles zur Silberpassivierung
Einleitung
Silber hat eine sehr ausgeprägte Neigung mit in der Umgebung befindlichem Schwefel zu reagieren und dabei Silbersulfid zu bilden. Neben der Unansehnlichkeit der Schicht gibt es technische Nachteile, so dass versilberte Artikel häufig nach der Veredelung noch gegen diese Reaktion geschützt werden. Das Silber wird so passiv gegenüber dem Schwefel. Daher spricht man häufig auch von einer Silberpassivierung. Ein weiterer Begriff für den gleichen Prozess ist z.B. „Anlaufschutz“, da diese Reaktion aus der Vergangenheit als Anlaufen von Silberbesteck bekannt ist.


Es gibt eine ganze Reihe von unterschiedlichen Systemen, die einen solchen Anlaufschutz gewähren. Dabei bietet neben der rein technischen Klassifizierung auch die Vielzahl von Anbietern mit Ihren Marken- und Produktnamen reichlich Stoff für babylonische Verwirrung.
Ziel der Untersuchung ist es, diesen Bereich besser zu strukturieren. Weiter soll der vorliegende Vortrag dazu diesen, Anwendern und Nutzern dieser Technologie eine gemeinsame Grundlage für die Definition von Parameter zu geben.
Inhalt
Passivierungstypen
Unbeachtet von Produkt- und Markennamen der Anbieter kann man Passivierungen grob in zwei Klassen einteilen:
- metallische Silberpassivierungen
- organische Silberpassivierungen
Die metallischen Passivierungen basieren auf der Abscheidung der dünnen Schicht eines anderen Metalls. Hier kommt eine Vielzahl von Elementen in Betracht. Am verbreitetsten sind hier wohl: Chrom/Chromat, Zinn und Indium. Chromat-basierte Silberpassivierungen sind inzwischen durch die Regelungen von RoHS und REACh fast durchgängig vom Markt verschwunden. Einzig einige Luft- und Raumfahrt-Anwendungen, sowie bestimmte Medizinprodukte setzen noch auf dieses System. Relativ neu ist der Einsatz von Indium.
Der Metallfilm wird in der Regel entweder klassisch unter Zuhilfenahme von Strom abgeschieden oder als Konversionsschicht auf chemischem Wege abgeschieden.
Die im Bereich der Steckverbinder wohl verbreitetste Passivierungsform auf Basis von Thiolenen gehört zur zweiten Klasse, den sog. organischen Silberpassivierungen. Diese werden im Allgemeinen durch Tauchen in entsprechende Flüssigkeiten aufgebracht. Solche Lösungen können auf wässriger Basis oder auf Basis eines organischen Lösungsmittels angesetzt sein.
Neben dem Thiolenen gibt es weitere Systeme, die dieser Klasse zugeordnet werden können.
Versilberungstypen
Wie alle galvanischen Prozesse unterliegt auch die Versilberung einer überwältigenden Anzahl von Parametern, die einen direkten Einfluss auf die Morphologie der Schicht und damit natürlich einen Effekt auf die Oberflächen-Chemie haben können.
Haupteinflussquelle für solche Effekte ist sicherlich der verwandte Elektrolyttyp. Im Bereich der technischen Versilberung finden wir neben dem cyanidischen, zusatzfreien Elektrolyten auch solche, die mit Zusätzen zur Einebnung, Glanzbildung oder Schichthärtung arbeiten. Weiter sind durch das hohe Gefährdungspotenzial der Cyanide – diese sind hochgiftig – inzwischen auch cyanfreie und saure Elektrolyte verfügbar.
Ein weiterer wichtiger Faktor sind die Abscheideparameter, mit denen die Schicht erstellt wurde. Hierzu gehören Stromdichte [A/dm²], Zeit [Min.] und Temperatur [°C]. Aber auch die genaue Konzentration der Elektrolytchemie.
Zuletzt hat das Alter der Schicht ebenfalls einen direkten Einfluss auf die Grenzfläche, die sich auf die Wirksamkeit der Silberpassivierung auswirken könnte. Neben Umlagerungen in der Kristallstruktur ist die Ausbildung von Oxiden und hier insbesondere Sulfiden zu nennen.
Eingesetzter Elektrolyt
Für den Hauptanteil der Untersuchungen kam ein cyanidischer, zusatzfreier Elektrolyt gemäß folgendem Rezept zum Einsatz:
125,0 g/l AgCN (als AgCN mit 48% Metallgehalt)
220,0 g/l KCN
30,0 g/l K2CO3
Die Werte (60 g/l Silber und 180 g/l freies Cyanid) wurden im Verlaufe der Versuche regelmäßig kontrolliert und die Konzentrationen weitestgehend konstant gehalten. Der Elektrolyt wurde für die Herstellung von maximal 60 Blechen eingesetzt und danach verworfen.
Anfertigung der Versuchsbleche
Die Versuche zur Silberpassivierung wurden allesamt an sog. Hull-Zellen-Blechen vorgenommen. Diese wurden vor der Passivierung in der Zelle mit obigem Elektrolyten versilbert.


Der Elektrolyt wurde bis auf wenigen Ausnahmen während der Abscheidung durch einen Magnetrührer bewegt. Die Abscheidung erfolgte bei Raumtemperatur im Standardfall bei 1 A und 5 Minuten.
Das Ergebnis waren Bleche mit folgendem Schichtdickenverlauf:
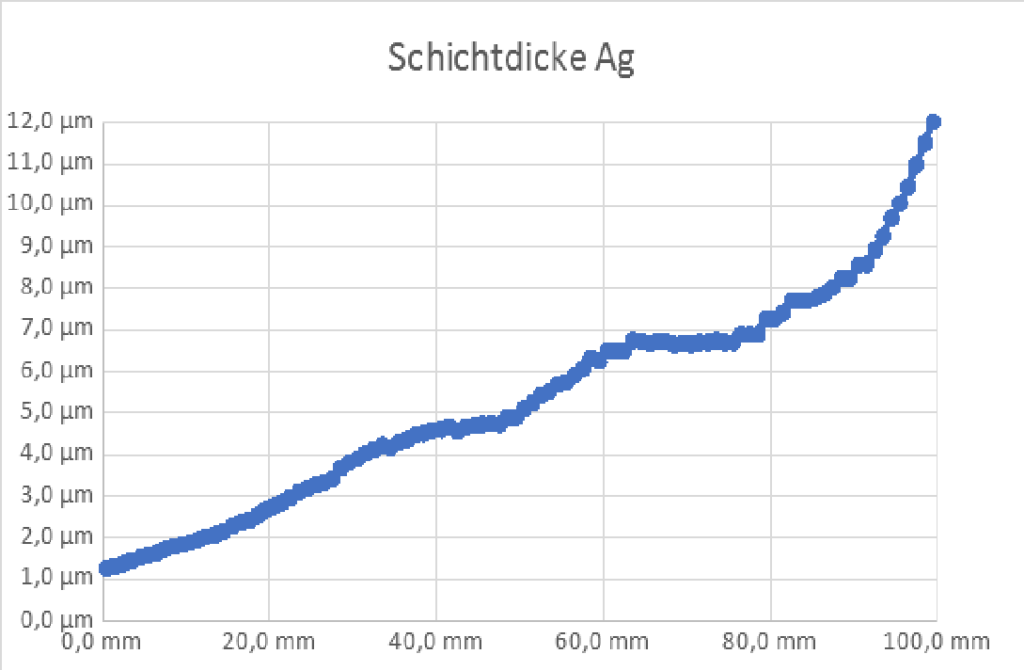
Messmethoden
Der Hauptanspruch der Silberpassivierung ist die Verhinderung einer Reaktion mit Schwefel unter Bildung von Silbersulfid Ag2S:
2 Ag+ + S2- -> Ag2S
Es ist also naheliegend zur Prüfung der Passivierungs-Leistung die Oberfläche einer großen Konzentration mit Sulfid-Ionen zu beaufschlagen. In einem Labor- oder sogar Produktionsumfeld bietet sich hier eine wässrige Lösung an. Theoretisch möglich und u.U. auch sinnvoller wäre die Auslagerung in einer sulfidischen Atmosphäre, die sich aber nicht so bequem darstellen und mit geringen Risiken handhaben lässt.

Analysetypen
Bei der Analyse der den käuflichen Systemen beigefügten Verfahrensanleitungen trifft man immer wieder auf zwei Quellen für die Sulfid-Ionen: Ammonium-Sulfid (NH4)2S (CAS 12135-76-1, verfügbar als 20%ige Lösung) und Kaliumsulfid K2S (CAS 1312-73-8, verfügbar als wasserlösliches Salz).
| Sulfid-Quelle | Ammonium-sulfid | Kalium(poly)- sulfid 42% |
Natriumsulfid Nonahydrat |
|---|---|---|---|
| Formel | H8N2S | K2S(x) | Na2S*9 H2O |
| Zugabe HNO3 | Ja | Nein | Nein | Nein |
| CAS-Nr.: | – | 37199-66-9 | 1313-84-4 |
| Molare Masse | 68,14 g/mol | 72,17 g/mol | 240,18 g/mol |
| Farbe | gelblich | ocker | farblos |
| Geruch | sehr stark | stark | gering |
| Dichte | 1,01 g/ml | 1,02 g/ml | 1,02 g/ml |
| pH-Wert | 9,48 | 9,51 | 12,00 | 12,92 | 12,50 |
| Leitfähigkeit | 3.550 µS 2.980 µS |
2.680 µS | 7.430 µS 1.780 µS |
| c(S2-) | 0,29 mol/l | 0,27 mol/l | 0,29 mol/l 0,58 mol/l |
| Einwaage | 1:10 | 20 g/l | 70 g/l | 140 g/l |
Beide Stoffe hydrolysieren in der Lösung unter Heraufsetzung des pH-Werts und gehen unter Einfluss von Sauerstoff leicht in das entsprechende Thiosulfat über. Beim Einsatz ist es daher wichtig darauf zu achten, dass die Lösungen nur relativ kurz lagerfähig sind. Entsprechende Hinweise finden sich in allen betrachteten Verfahrensanweisungen. Auch schreiben alle Testvorschriften die Prüfung der Wirksamkeit an einem nicht-passivierten Werkstück vor.
Nachbehandlung und Auswertung
Vielfach wird vor dem obligatorischen Trocknen die Probe mit Ethanol gespült, um Flecken bei der Trocknung zu vermeiden. Anschließend ist entweder mit Warmluft oder bei Raumtemperatur zu trocknen. Im Falle der Warmlufttrocknung sollte die Temperatur nicht zu hoch sein, da beispielsweise viele organische Silberpassivierungen bei hohen Temperaturen zum „Verfliegen“ oder Zersetzen neigen und sich Ag2S ebenfalls bei ca. 300°C zersetzt und Reinsilber auf der Oberfläche zurücklässt.
Die Prüfung der Passivierungsleistung wurde zunächst immer direkt nach der Veredelung durchgeführt, um einen Vergleich über die verschiedenen Systeme zu erhalten. Im Anschluss daran wurde mit zwei ausgewählten Prozessen ein Vergleichstest ausgeführt, bei dem Bleche direkt nach der Veredelung, sowie 24 und 48 Stunden nach der Veredelung getestet wurden. Die Silberpassivierung wurde dabei generell sofort aufgebracht.
Ergebnisse
Unterschiede in der Testung
Zunächst einmal galt es zu Vereinfachung der weiteren Vorgehensweise zu klären, ob die unterschiedlichen Testverfahren zu den gleichen Ergebnissen führen würden. Hierzu wurden eine Reihe von Testblechen in die unterschiedlichen Lösungen eingebracht.


Die in den Vorschriften durchgängig vorgeschriebene Vorprüfung mit einem nicht passivierten Muster bietet sich an, die alle Lösungen nur sehr begrenzt haltbar sind. Dennoch hat sich im Laufe unserer Versuche gezeigt, dass auch gealterte Lösungen durchaus noch brauchbare Resultate ergeben. Eine maximale Einsatzzeit von nur wenigen Minuten nach dem Ansatz erscheint uns daher übertrieben.
Unterschiede der Testsubstanzen
Dennoch sollten die Lösungen auch nach unserem Dafürhalten nicht länger als 2-3 Stunden zum Einsatz kommen. Die Lösungen sind wegen Ihrer Reaktion mit Sauerstoff und CO2 im außerhalb der Testung in jedem Fall abzudecken; besser in einer Flasche luftdicht zu lagern. Das Ammoniumsulfid baut in seiner Leistungsfähigkeit deutlich schneller ab als eine Kaliumsulfidlösung.
Das Ergebnis zeigt Unterschiede beim Einsatz von Ammonium- und Kaliumsulfid.

Als erstes Fazit kann man klar sagen, dass der Angriff durch die Ammoniumsulfid-Lösung bei organischen Systemen in der Regel aggressiver und meist deutlicher ausfällt als der durch das Kaliumsalz. Bei den metallischen Silberpassivierungen verhält es sich umgekehrt. Dennoch sind im internen Vergleich beide Systeme zulässig. Ein Vergleich der Ergebnisse zwischen dem Ammonium- und dem Kaliumtest ist aber unzulässig.
Expositionszeit
Einen deutlich sichtbaren Unterschied bei den verschiedenen Expositionszeiten konnten wir im Labor unter den gegebenen Umständen nicht nachweisen.

Eine längere Expositionszeit der Oberfläche im Reagenz verdeutlicht im direkten Vergleich die Passivierungsleistung. Dennoch ist schon bei einer Zeit von 5 Sekunden klar zu erkennen, ob die Silberoberfläche noch geschützt ist oder nicht.
Einfluss der Stromdichte
Die Ergebnisse der hier gezeigten Ammoniumsulfid-Tests zeigen aber einen weiteren, sehr viel komplexeren Einfluss auf die Passivierungsleistung: im Bereich hoher Stromdichten (also links auf allen gezeigten Blechen) arbeitet die Silberpassivierung scheinbar besser, als im Bereich niedriger Stromdichten.

Die resultierende Fragestellung ist nun: liegt es an der Schichtdicke oder an der Struktur der Beschichtung. Letzteres wäre in naheliegender. Dazu muss man wissen, wie organische Passivierungen arbeiten.
Funktionsweise organischer Silberpassivierungen
Am Beispiel des Octathiols kann man relativ gut erkennen, dass das Molekül zwei funktionell sehr unterschiedliche Enden besitzt. In unten stehender Notation steht jeder nicht weiter bezeichnete Winkel für ein Kohlgenstoff-Atom mit der entsprechenden Anzahl von Wasserstoff-Atomen.
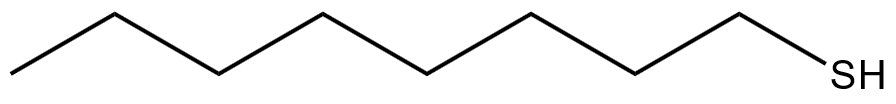
Die große Neigung von Silber, sich mit Schwefel zu verbinden ist schon hinreichend beschrieben. Sie bildet schließlich die Basis für diese Untersuchungen. Es ist also davon auszugehen, dass sich das „Schwefel-Ende“ des Moleküls in Richtung der Silberoberfläche orientieren wird. Dabei sorgt aber der Rest des Moleküls dafür, dass eine echte Reaktion mit dem Silber nicht stattfinden kann. Es handelt sich also um eine Assoziation und nicht um eine Reaktion.
Hinzu kommt, dass das andere Ende des Moleküls als klassischer Kohlenwasserstoff hydrophob, also wasserabweisend ist. Wasser spielt z.B. in Form von Luftfeuchtigkeit als Lösungsmittel oder sogar als direkter Beteiligter an den Reaktionsprozessen bei Reaktionen von Metallen mit der Atmosphäre eine entscheidende Rolle.
Wenn nun die Silberoberfläche mit einer großen Konzentration dieses Moleküls aussetze, so ergeben sich sogenannte „Self Assembling Monolayers SAM“:
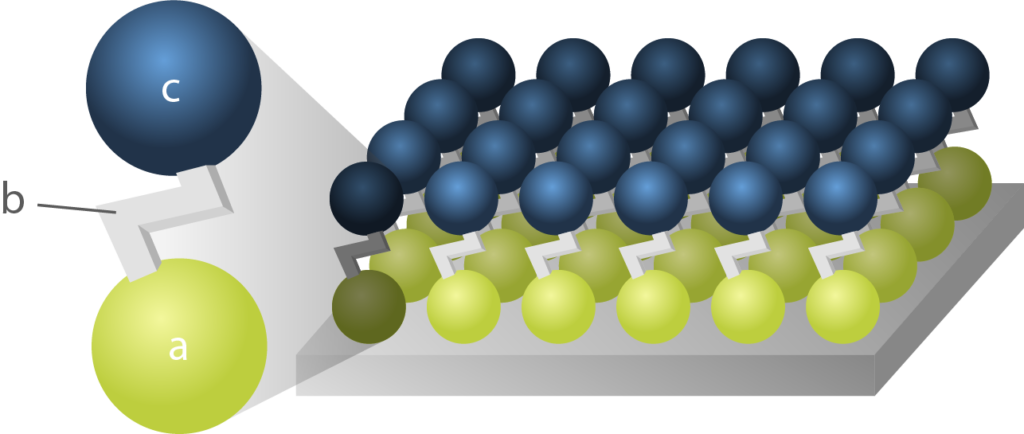
Der Vorteil liegt auf der Hand: Die einlagige Schutzschicht verhindert, dass Schwefel aus der Umwelt und Wasser an die Silberoberfläche vordringen können. Die Schicht kann durch Zufuhr von Energie aber relativ leicht wieder gelöst werden, was mit einem Reaktionsprodukt, wie Silbersulfid nicht so leicht möglich wäre. Somit beeinträchtigt die Silberpassivierung mögliche Folgereaktionen, die sich z.B. aus der Anwendung der Beschichtung ergeben, nicht oder nur kaum. Allerdings ist diesem Umstand auch die geringere Haltbarkeit der organischen Passivierungstypen geschuldet. Diese verflüchtigen sich im Laufe der Zeit und legen dabei metallisches Silber frei.
Es ist tatsächlich naheliegend, dass die Struktur der Oberfläche auch einen direkten Einfluss auf die Orientierung der Moleküle im SAM haben muss und somit auch die Dichte der Schicht entscheidend beeinflusst.
Überprüfung im Experiment
Zur Prüfung dieser Theorie haben wir die Bleche in der Hull-Zelle bei verschiedenen Zellströmen mit jeweils verlängerter Expositionszeit angefertigt. Ziel war, trotz des unterschiedlichen Zellstroms vergleichbare Schichtdicken abzuscheiden. Die Bleche wurden anschließend mit einer ausgewählten, Thiol-basierten Silberpassivierung nach Anleitung behandelt und anschließend mit dem Ammoniumsulfid-Test überprüft.
Gleiche Schichtdicken, variierte Stromdichten/Expositionszeiten
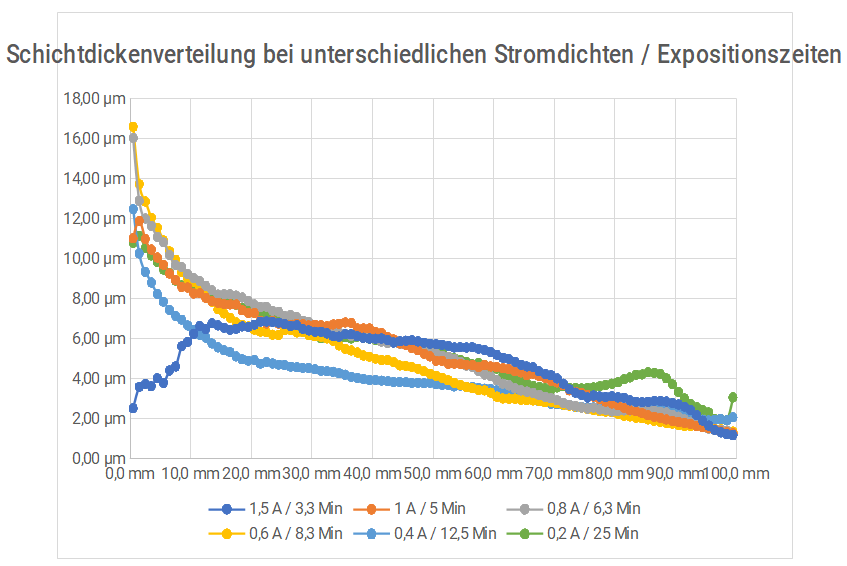
Der Verlauf zeigt, dass das Ziel vergleichbare Schichtdicken zu erzeugen hinreichend gut erreicht werden konnte. Die Randbereiche der Hull-Zellen-Bleche unterliegen besonderen Verhältnissen und sollten im Allgemeinen ohnehin besser nicht betrachtet werden. Der Schichtabfall im Bereich der hohen Stromdichte bei der Kurve „1,5 A / 3,3 Min“ ist auf einen Überblend-Effekt / Verbrennungen durch zu hohe lokale Stromdichten zurückzuführen.

Man kann auf den Blechen beim Übergang von hohen zu niedrigen Stromdichten drei Bereiche unterscheiden. Exemplarisch am Ergebnis der Reihe „0,6 A / 8,3 Min.“ gibt es den silbrig-weißen Bereich der hohen Stromdichten der auch nach dem Sulfid-Test keine Verfärbung zeigt. Im Bereich der niedrigen Stromdichten zeigt sich die für den Test typische, gräuliche, eher inhomogene Verfärbung der Oberfläche. Dazwischen liegt ein Übergangsbereich.
| Messreihe | Übergang | Auflage |
|---|---|---|
| 1,5 A / 3,3 Min. | 7,6-8,4 cm | 2,8-3,1 µm |
| 1,0 A / 5,0 Min. | 7,3-8,1 cm | 2,4-3,3 µm |
| 0,8 A / 6,3 Min. | 6,4-7,4 cm | 2,5- 3,1 µm |
| 0,6 A / 8,3 Min. | 3,8-5,1 cm | 3,9-5,1 µm |
| 0,4 A / 12,5 Min. | 0-4 cm | 3,9-12,5 µm |
| 0,2 A / 25,0 Min. | – | – |
Die Auswertung der Ergebnisse zeigt, dass sich die Zone, in dem die organische Silberpassivierung den Test gut übersteht bei kleinerem Zellstrom immer weiter in den hohen Stromdichtebereich verschiebt. Die Bleche mit 0,4 und 0,2 A zeigen kaum noch eine Zone, die als passiviert beschrieben werden könnte. Die angewandte Stromdichte hat also einen Einfluss auf die Leistung der Passivierung.
Unterschiedliche Schichtdicken und Stromdichten bei gleichen Expositionszeiten
Um diesen Effekt besser zu verstehen wurde in einer weiteren Messreihe noch einmal mit den gleichen Zellströmen, aber konstanter Zeit gearbeitet. Die Verteilung der Schichtdicken war erwartungsgemäß:
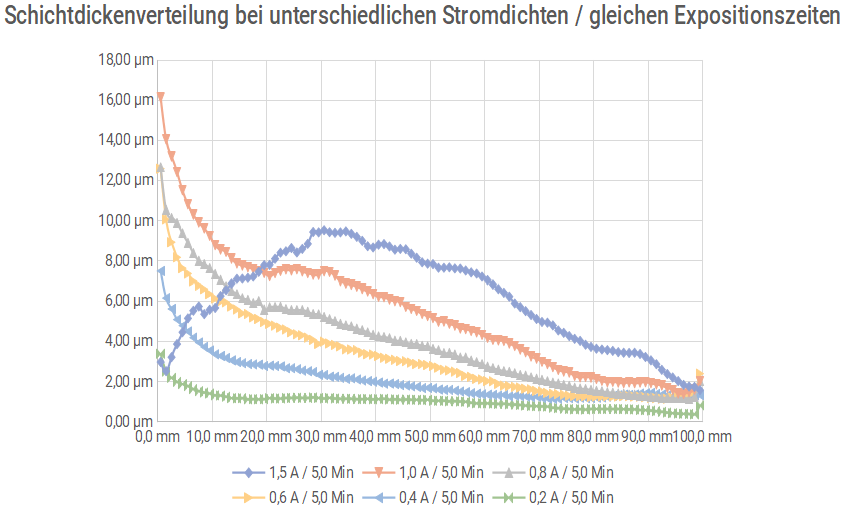
Die Lage der Übergangszone ist im Rahmen der Genauigkeit, die bei dieser Art Versuch zu erwarten ist, durchaus vergleichbar:
| Messreihe | Übergang | Auflage |
|---|---|---|
| 1,5 A / 3,3 Min. | 7,8-8,4 cm | 3,4-3,8 µm |
| 1,0 A / 5,0 Min. | 6,4-7,3 cm | 2,5-3,8 µm |
| 0,8 A / 6,3 Min. | 6,0-6,4 cm | 2,4-2,7 µm |
| 0,6 A / 8,3 Min. | 2,8-5,0 cm | 2,8-3,9 µm |
| 0,4 A / 12,5 Min. | 2,0-3,4 cm | 2,2-2,8 µm |
| 0,2 A / 25,0 Min. | – | – |
Unbestritten ist, dass die lokale Stromdichte einen Einfluss auf die Struktur einer galvanisch abgeschiedenen Schicht hat. Diese Struktur beeinflusst ihrerseits die Oberflächenchemie der Schicht, was wiederum einen Einfluss auf die Passivierungsleistung eines organischen Systems hat. Dieser Effekt ist von der tatsächlich abgeschiedenen Schichtdicke unabhängig.
Fazit
Zum Zeitpunkt der Erstellung dieses Aufsatzes sind die Versuche um die Silberpassivierung noch nicht abgeschlossen. Hinsichtlich der Testbedingungen sind aber einige Dinge zu empfehlen:
- Es muss grundsätzlich hinterfragt werden, ob eine Silberpassivierung überhaupt zwingend ist.
- Es muss weiter hinterfragt werden, welche Aufgabe die Silberpassivierung tragen soll und inwiefern die hier beschriebenen, praktisch üblichen Testverfahren zum Nachweis geeignet sind.
- Für organische Silberpassivierungen ist der Ammoniumsulfid-Test strenger. Für metallische Silberpassivierungen ist der Kaliumsulfid-Test strenger.
- Die Test-Lösungen sind nicht länger als 2-3 Stunden nach Ansatz haltbar
- Der Zusatz von Salpetersäure hat keinen erkennbaren Einfluss auf das Ergebnis. Insofern raten wir vom Einsatz ab.
- Eine Expositionszeit von 5 Sekunden ist ausreichend. Jede längere Zeit ist möglich. Eine Abschwächung des Ergebnisses konnten wir nicht nachweisen.
- Die Ergebnisse können prinzipiell nur miteinander verglichen werden. Ein Vergleich z.B. des gleichen Teils mit Ammonium- und Kaliumsulfid-Test ist unzulässig. Ein Vergleich unterschiedlicher Muster bei gleichem Test ist ebenfalls unzulässig. Der Vergleich gleicher Muster aus unterschiedlichen Versilberungen ist ebenfalls unzulässig.
- Die lokale Stromdichte bei der Erstellung der Silberschicht hat einen direkten Einfluss auf die Passivierungsleistung eines organischen Systems, wie z.B. Thiol.
Ausblick
Das Projekt läuft weiter. Es sind noch einige Parameter zu hinterfragen und zu bewerten. Hierzu sind spezielle Untersuchungen nötig.
Aktuell laufen z.B. Untersuchungen, die die einzelnen, am Markt verfügbaren Systeme untereinander vergleichen. Ziel ist es eine Marktübersicht und eine Bewertung der Systeme vorzunehmen und diese zu Veröffentlichen. Hier stehen auch Überlegungen zu den Kosten an.
Auch sind noch immer Fragestellungen nach der Wirksamkeit und Haltbarkeit der Systeme offen.
Es wurde deutlich, dass die Oberflächenstruktur der Silberschicht einen Einfluss auf die Wirksamkeit der Passivierung haben kann. Bisher wurde dies nur an einem zusatzfreien Standardelektrolyten untersucht. Es gibt aber durchaus marktrelevante Elektrolyte, die z.B. härtere oder glänzende Schichten abscheiden. Auch ist der Wunsch groß, Silber-Elektrolyte einzusetzen, die nicht auf dem hochgiftigen Cyanid basieren. Diese Formulierungen werden ihrerseits einen Einfluss auf die Oberfläche haben, den es zu untersuchen und zu bewerten gilt.
Neben dem reinen Schutz vor dem Anlaufen der Silbersicht sind weitere Eigenschaften der Silberpassivierungen bzw. der Silbersulfid-Schicht für einige speziellen Anwender von großer Bedeutung. Hier gilt es auf Basis der Ergebnisse zu untersuchen, welchen Einfluss die unterschiedlichen Oberflächen z.B. auf Übergangswiderstände oder die Tribologie haben.
Schlussendlich sollen Verfahrensfehler betrachtet und bewertet werden. Ziel ist es einen Fehlerkatalog und ein „Best Practice“ Paper zu entwickeln und dem Markt zur Verfügung zu stellen.
Verweise
Berkenhoff, N. (2019). LK2070 – Anlaufschutz von Silberschichten. Lüdenscheid: Leopold Kostal GmbH & Co. KG.
DIN 50957-1: Prüfung galvanischer Bäder – Galvanisierungsprüfung – Teil 1: Standard-Hull-Zelle. (2016). Berlin: DIN e.V.
Hollemann, A. F. (1995). Lehrbuch der anorganischen Chemie. Berlin: Walter de Gruyter & Co.
Jelinek, T. W. (2007). Hull-Zelle zur Untersuchung von galvanischen Elektrolyten. Bad Saulgau: Eugen G. Leuze Verlag.
Jelinek, T. W. (2013). Praktische Galvanotechnik. Bad Saulgau: Eugen G. Leuze Verlag.
Kaiser, H. (2002). Edelmetallschichten. Bad Saulgau: Eugen G. Leuze Verlag.
Vinaricky, E. (2002). Elektrische Kontakte, Werkstoffe und Anwendungen. Berlin: Springer-Verlag.




