
Edelmetall-Einsatz in Galvaniken
Ein bisschen Schwund ist immer ?!
Inhaltsverzeichnis
- Edelmetall in der Galvanik
- Ein bisschen Schwund ist immer ?!
- Beispiel: Cu-Ag2 100 x 1,00 mm
- Die Edelmetall-Grammage
- Basis: die Theorie des idealen Kastens
- Praxis-Aufschlag 1: Die Schichtdicken-Sicherheit
- Praxis-Aufschlag 2: Der Hundeknochen-Effekt
- Zwischenfazit
- Verluste 1: Ausschleppung
- Verluste 2: Die Bad-Chemie
- Verluste 2: Abarbeitung der Anoden
- Fazit

Wenn man bei einer Galvanik eine Beschichtung bestellt, gibt es grundsätzlich zwei Arten der Kalkulation: Entweder man erhält einen Bearbeitungspreis, in dem der Metalleinsatz bereits enthalten ist oder das Angebot des Lieferanten umfasst die separate Ausweisung von Bearbeitungskosten und Metalleinsätzen. Dies ist beim Edelmetall-Einsatz in der Galvanik von besonderem Interesse.
Es sind durchaus auch Mischformen üblich. Diese finden sich oft dort, wo der Preisanteil der Industriemetalle, wie z. B. Zink, Nickel oder Kupfer, im Vergleich zum Bearbeitungspreis sehr gering ausfällt. Kommen aber Edelmetalle wie Silber, Gold, Platin oder Palladium in der Galvanik zum Einsatz, finden wir sehr oft die umgekehrte Situation: Der Metallwert übersteigt die eigentliche Wertschöpfung des Galvaniseurs um ein Vielfaches.

Speziell in diesem Spannungsfeld kommt ein weiterer wichtiger Faktor zum Tragen: Die Kurse der Metalle werden werktäglich und überall auf der Welt durch die Börsen neu festgelegt. Somit gilt es Kursschwankungen zu tragen. Wir finden daher sehr oft Tageskurse als Basis für die Edelmetall-Abrechnung mit dem Lieferanten, der so das Schwankungsrisiko auf seinen Kunden abwälzt. In diesem Zusammenhang kommt dem Datum der Fixierung ein besonderes Gewicht zu, das weithin unterschätzt wird. Aber dazu berichten wir vielleicht einmal an anderer Stelle.
Neben den diversen kaufmännischen Risiken und Aufschlägen fällt weiterhin auf, dass zwischen dem abgerechneten Edelmetall-Gewicht und den tatsächlich nach der Beschichtung auf den Waren befindlichen Massen eine deutliche Differenz besteht.
Woher diese – zum großen Teil technisch bedingte – Differenz stammt, wollen wir im Folgenden behandeln.
Beispiel: Cu-Ag2 100 x 1,00 mm
Im Folgenden verwenden wir der Einfachheit halber ein Bandmaterial aus Kupfer der Abmessung 100 x 1, das mit 2 µm Silber beschichtet werden soll. Die Erklärungen lassen sich, zumal mit einem geeigneten CAD-Programm, aber recht leicht auch auf sehr komplexe Strukturen übertragen.
Die Edelmetall-Grammage
Basis für die Abrechnung von Metallen ist immer die sog. Grammage. Zur Funktion einer Schicht ist immer eine Mindest-Schichtdicke zu definieren. Diese erfolgt dann in Bezug zu einem Gesamtgewicht oder einer Teilanzahl. Bei Bandwaren also z. B. als „4,5 g/kg“. Je Kilogramm gelieferten Materials rechnet die Galvanik hier also 4,5 g Edelmetall ab. Bei Teilen finden wir 4,5 g/Stück oder z. B. bei Stanzgittern oder Trommelware auch 4,5 g/1.000 Stück. Die Grammage wird durch die simple Multiplikation des Schicht-Volumens mit der Dichte des Schichtmaterials berechnet.
Basis: die Theorie des idealen Kastens
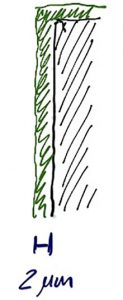
Zunächst einmal geht vermutlich jeder unerfahrene Kunde davon aus, dass sein Lieferant ihm die spezifizierte Schichtdicke (in unserem Beispiel 2 µm Silber) an jeder Stelle seines Artikels abscheidet. Diese Betrachtung nutzen wir als Ausgangspunkt.
Zur Ermittlung der Grammage legen wir einen idealen Kasten um unser Beispielband wie in Abbildung 1 skizziert.
Berechnungsgrundlage ist also die Relation der Abmessung des Grundmaterials (hier reicht uns zunächst die Fläche 100 x 1,00 mm) in Relation zur Fläche des beschichteten Materials. Da die Beschichtung beidseitig aufgebracht wird, ist ihr Wert bei der Berechnung zu verdoppeln:
2 µm + 2 µm = 4 µm = 0,004 mm
Somit ergibt sich für die Flächenberechnung der Beschichtung folgende Formel:
Ages = (100,004 x 1,004) mm2 – (100,000 x 1,000) mm2
= 0,404 mm² = 0,00404 cm²
Mit der Dichte des Silbers (10,49 g/cm³) ergibt sich dann ein sogenanntes Metergewicht, also das Schichtgewicht, das auf genau einem Meter Grundmaterial abgeschieden werden würde. Wir verwenden hier die Einheit Zentimeter, damit es bei den Kommastellen überschaubar bleibt:
10,49 g/cm³ * 0,00404 cm² = 0,04 g/cm
Zur Relation fehlt hier nun noch das Metergewicht des Grundmaterials, dass sich aus der Abmessung des Materials und der Grundmaterialdichte analog zu 0,089 kg/cm ergibt. Somit ist die Grammage:
0,04 g/cm / 0,09 kg/cm = 0,44 g/kg
Auf Basis der Theorie des idealen Kastens folgt, dass sich auf dem Material pro Kilogramm Substrat 0,44 Gramm Edelmetall befinden. Dies zur Theorie. Kommen wir nun zur Praxis.
[ds_preview]
Praxis-Aufschlag 1: Die Schichtdicken-Sicherheit
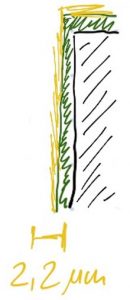
Es ist immer das Minimum einer Schichtdicke, das seine Funktion bestimmt. Der Prozess der galvanischen Abscheidung unterliegt aber einer Vielzahl von Einflussfaktoren, deren Stabilität in der Praxis häufig innerhalb nicht unerheblicher Korridore schwanken kann. Daher wird der Lieferant bei der Anlage seiner Prozessparameter immer einen gewissen Sicherheitsaufschlag auf die Mindestschichtdicke legen. Dies soll garantieren, dass selbst im ungünstigsten Fall die Mindestauflage erreicht wird.
Da dieser Fall aber die Ausnahme und nicht die Regel ist, liegt die durchschnittliche Schichtdicke grundsätzlich über der Mindestforderung. Je nach Prozesstyp und Anlagenführung kann diese Sicherheit stark schwanken.
In unseren Fall haben wir zur weiteren Berechnung mal einen Puffer von 10 % bestimmt, arbeiten also im Folgenden mit 2,2 µm.
0,44 g/kg + 10% = 0,48 g/kg
Praxis-Aufschlag 2: Der Hundeknochen-Effekt
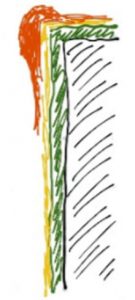
An jeder Material- bzw. Beschichtungskante baut sich, bedingt durch den sogenannten Hundeknochen-Effekt, bei der Abscheidung mehr Material auf als auf den Flächen. Hintergrund ist, dass sich das Feld an solchen Stellen verdichtet und somit mehr Strom fließen kann, als auf den glatten Flächen.
Da die Forderung nach einer Mindestschichtdicke von 2 µm bedingt durch die Funktion der vorherrschende Parameter ist und die Schicht nicht nur „im Mittel“ mindestens 2 µm dick sein soll, hat dieser Effekt insbesondere bei komplexen Teilen einen zum Teil erheblichen Einfluss auf den Edelmetall-Einsatz in der Galvanik.
Es gibt eine grobe Faustformel für eine überschlagsmäßige Abschätzung dieses Effekts: Je größer der Abstand zwischen zwei Kanten ist, desto kürzer und dicker fällt dieser Effekt aus.
Der Veredler kann diesem Phänomen durch Blenden, der Anordnung der Anoden oder auch mit sogenannten Hilfselektroden entgegenwirken. Auch die Stromdichte hat einen deutlichen Einfluss auf die Ausprägung des Effekts. Sämtliche dieser Maßnahmen haben aber durch Anlagengeschwindigkeit oder Rüstzeiten einen Einfluss auf den Bearbeitungspreis. Somit sind die zu treffenden Maßnahmen immer auch im Verhältnis zu Preis und Materialeinsatz zu sehen.
Die Ausprägung des Hundeknochen-Effekts ist sehr stark von Anlage, Artikel und Material abhängig. Eine Simulation des Effekts ist nur dann möglich, wenn wir sehr gute Kenntnisse über die Geometrie der eingesetzten Zelle haben, was in diesem Fall nur beim Beschichter gelingen kann. Wir setzen daher hier nun eher beliebig einen weiteren Aufschlag von 5 % an:
0,48 g/kg + 10% = 0,50 g/kg
Zwischenfazit
Der Galvaniseur muss schon jetzt 0,06 g/kg mehr Edelmetall in seinen Prozess stecken, als der Kunde ursprünglich spezifiziert hatte. Diese Mengen erhält der Kunde aber in der einen oder anderen Weise auf seinem Material zurück.
Verluste 1: Ausschleppung

Bei Verlassen des Aktivbads verbleiben Elektrolytreste auf der Oberfläche des Teils. Diese Reste enthalten Edelmetalle-Ionen, die dem Bad auf dieses Weise entzogen werden.
Es gibt eine Vielzahl von Methoden, um diese Ausschleppungen zu vermeiden oder das bereits ausgeschleppte Material zurückzugewinnen. Hierzu zählen verschiedene Abstreifer-Systeme, sog. Luftmesser oder Abblasungen, sowie die diversen Systeme zur Edelmetall-Rückgewinnung aus Spülwässern.
Völlig vermeiden lassen sich solche Verluste aber nie. Auch hier steht aber im Vordergrund, wie sicher der Lieferant seinen Prozess im Griff hat und welche der obigen Maßnahmen zum Einsatz kommen.
Verluste 2: Die Bad-Chemie
Die Ionen im Elektrolyten unterliegen diversen, chemischen und elektro-chemischen Prozessen, die sie in der Art verändern, dass sie dem eigentlichen Abscheidungsprozess nicht mehr zur Verfügung stehen. Dies können Oxidationen, Komplexierungen oder auch Ausfällungen sein.
Die so „verlorenen“ Mengen müssen von Zeit zu Zeit aus dem Prozess entfernt werden, was mit entsprechenden Verlusten einhergeht. Im Prinzip gilt aber auch hier genau wie im vorangegangenen Abschnitt, dass dem Galvaniseur eine Vielzahl von Maßnahmen zur Verfügung stehen, diese Verluste bestmöglich zu minimieren.
Verluste 2: Abarbeitung der Anoden

Im Aktivbad werden zur Konstanthaltung der Edelmetall-Ionen-Konzentration im Elektrolyten meist lösliche Anoden aus dem gleichen Material eingesetzt. D. h. in einem Silber-Elektrolyten hängen im Allgemeinen Anoden aus Reinsilber, die sich parallel zur Abscheidung auf dem Kundenartikel auflösen.
Letztere Auflösung erfolgt meist leider nicht zu 100 %. Es verbleiben Reste im Bad oder den Halteeinrichtungen, die dem Prozess dann nicht mehr zur Verfügung stehen.
Diese Anoden-Reste und -Schlämme kann man dem Recycling zuführen und erhält einen Teil des Materials in Form von frischen Anoden zurück. Dennoch verbleibt auch hier ein unvermeidbarer Verlust.
Die Alternative, die Edelmetall-Ionen direkt als Salze dem Elektrolyten zuzugeben, ist bekannt und erschlossen, hat aber häufig technische und kaufmännische Nachteile.
Fazit
Je nach abzuscheidendem Metall, eingesetzter Anlagentechnik und Aufwand liegen die systematischen Verluste im Allgemeinen zwischen 5 und 250 %. In den Ausführungen nicht weiter berücksichtigt sind dabei die Verluste, die sich durch Kosten in der Materialtechnik und dem Recycling verstecken und somit indirekt auf das Einsatzgewicht durchschlagen.
Für den Fall der Bandgalvanik sind Verluste zwischen 5 und 35 % üblich. Davon abweichende Werte sollten Sie mit Ihrem Lieferanten besprechen.




